
JOSÉ ALONSO NOVELO BAEZA, Comisionado Federal para la Protección contra Riesgos Sanitarios y Presidente del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, con fundamento en lo dispuesto por los artículos 39 de la Ley Orgánica de la Administración Pública Federal; 4 de la Ley Federal de Procedimiento Administrativo; 3o., fracción XXIV, 13, apartado A, fracciones I y IX, 17 Bis, fracción III, 58, fracciones V Bis y VII, 107, 194, 195, 221, 222, 222 Bis, 224 Bis, 224 Bis 1 y 231 de la Ley General de Salud; 38, fracción II, 40 fracciones I, XI y XII, 41, 43, y 51 de la Ley Federal sobre Metrología y Normalización; 28 del Reglamento de la Ley Federal sobre Metrología y Normalización; 38, 81 Bis, 131, 177, fracción IX y 190 Bis 1, fracción V del Reglamento de Insumos para la Salud y 3, fracciones I, inciso b y II, 10, fracciones IV y VIII del Reglamento de la Comisión Federal para la Protección contra Riesgos Sanitarios, y
CONSIDERANDO
Que con fecha 19 de julio de 2017 se publicó en el Diario Oficial de la Federación la Norma Oficial Mexicana NOM-220-SSA1-2016, Instalación y operación de la Farmacovigilancia, siendo su entrada en vigor a los 180 días naturales posteriores al de su publicación;
Que la presente modificación se realiza como parte de las acciones tendientes a dar mayor claridad, simplificación y reducción de trámites que se llevan a cabo en materia de Farmacovigilancia ante la Comisión Federal para la Protección contra Riesgos Sanitarios, con base en la homologación con lineamientos internacionales que mantiene la farmacovigilancia acerca de las manifestaciones clínicas ocasionadas por el uso de medicamentos y vacunas.
Que el Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario aprobó el 28 de agosto de 2020, la Modificación de la Norma Oficial Mexicana NOM-220-SSA1-2016, Instalación y operación de la Farmacovigilancia;
Que la modificación se sometió al procedimiento de mejora regulatoria de conformidad con lo dispuesto por la Ley General de Mejora Regulatoria; indicando que dicha modificación no afecta a la industria actualmente establecida, obteniéndose la exención de análisis de impacto regulatorio el 31 de agosto de 2020; por lo que he tenido a bien expedir y ordenar la publicación de la siguiente
MODIFICACIÓN A LA NORMA OFICIAL MEXICANA NOM-220-SSA1-2016, INSTALACIÓN Y OPERACIÓN DE LA FARMACOVIGILANCIA
ARTÍCULO ÚNICO.- Se MODIFICAN los puntos 8.1.2.1, 8.1.11, Tabla 1, 8.1.11.1, Tabla 2, 8.2.1, 8.2.2, 8.2.4.4, 8.2.6.3, 8.2.9, 8.2.10.1, 8.3.1, 8.4.1, 8.4.1.1, 8.4.1.4, 8.4.3, 9.3 y 9.5; se ADICIONAN los puntos 8.2.2.1, 8.2.2.2, 8.2.7.3, 8.4.3.1.3.2, 8.4.3.1.4.2 y 8.5.3; se DEROGAN el último párrafo del punto 4.50.3, los puntos 7.4.2.2, 7.4.2.6, 7.4.2.7, 8.4.1.2, 8.4.1.3, 8.4.1.7, 8.4.2.2, 8.4.2.5, 8.4.3.1, 8.4.3.1.1, 8.4.3.1.1.1, 8.4.3.1.1.2, 8.4.3.1.1.3, 8.4.3.1.1.4, 8.4.3.1.2.1, 8.4.3.1.2.2, 8.4.3.1.2.3, 8.4.3.1.2.4, 8.4.3.1.2.5, 8.4.3.1.2.6, 8.4.3.2, 8.4.3.2.1, 8.4.3.2.2, 8.4.3.2.3, 8.4.3.2.3.1, 8.4.3.2.3.2, 8.4.3.2.4, 8.4.3.2.4.1, 8.4.3.2.4.2, 8.4.3.3, 8.4.3.3.1, 8.4.3.3.2, 8.4.3.3.3, 8.4.3.3.3.1, 8.4.3.3.3.2, 8.4.3.3.4, 8.4.3.3.4.1, 8.4.3.3.4.2, 8.4.4, 8.4.4.1, 8.4.4.1.1, 8.4.4.2, 8.4.4.2.1, 8.4.4.2.2, 8.4.4.2.3, 8.4.4.2.4, 8.4.4.2.5, 8.4.4.3, 8.4.4.3.1, 8.4.4.3.2, 8.4.4.3.3, último párrafo del punto 8.4.5.1, 8.4.5.2, 8.4.5.3, 8.4.5.4, 8.4.5.5, 8.4.5.6, 8.4.5.7 y 8.4.5.8 de la Norma Oficial Mexicana NOM-220-SSA1-2016, Instalación y operación de la Farmacovigilancia, publicada en el Diario Oficial de la Federación el 19 de julio de 2017, para quedar como sigue:
4.50.3 ...
Se deroga párrafo final.
7.4.2.2 Se deroga.
7.4.2.6 Se deroga.
7.4.2.7 Se deroga.
8.1.2.1 Todas las SRAM, EA, RAM, ESAVI y manifestaciones clínicas ocasionadas por otros problemas de seguridad relacionados con el uso de medicamentos y vacunas, tanto esperadas como inesperadas, que se presenten por:
8.1.11 Los tiempos de envío de las notificaciones en territorio nacional al CNFV, se establecen en la siguiente tabla:
Tabla 1. Tiempos de notificación de los EA, SRAM y RAM.

Para todos los casos el tiempo comienza a partir del Día Cero, es decir es el día en que el responsable de notificar tiene conocimiento del caso.
* Para los estudios clínicos que cuenten con al menos un sitio o centro de investigación en México, los casos graves que sucedan en el extranjero solo deberán incluirse en el reporte de seguridad final del estudio.
** Bajo el mecanismo que establezca el CNFV en la Guía de Farmacovigilancia para la notificación de EA, SRAM, RAM y ESAVI o cualquier problema de seguridad relacionado con el uso de medicamentos y vacunas.
8.1.11.1 Los tiempos de envío de la información en territorio nacional al CNFV de los ESAVI se establecen en la siguiente tabla:
Tabla 2. Tiempos de notificación de los ESAVI.
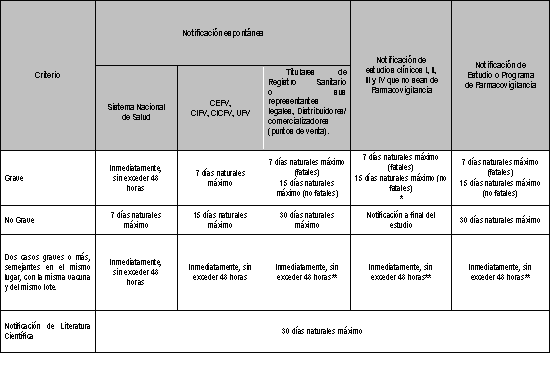
Para todos los casos el tiempo comienza a partir del Día Cero, es decir es el día en que el responsable de notificar tiene conocimiento del caso.
* Para los estudios clínicos que cuenten con al menos un sitio o centro de investigación en México, los casos graves que sucedan en el extranjero solo deberán incluirse en el reporte de seguridad final del estudio.
** Bajo el mecanismo que establezca el CNFV en la Guía de Farmacovigilancia para la notificación de EA, SRAM, RAM y ESAVI o cualquier problema de seguridad relacionado con el uso de medicamentos y vacunas.
8.2.1 Elaborar y mantener a disposición del CNFV los RPS de todos los medicamentos y vacunas autorizados, en el formato que el CNFV establezca en la "Guía de Farmacovigilancia para la elaboración del RPS", publicada por el CNFV en http://www.gob.mx/cofepris/documentos/guias-lineamientos-y-requerimientos-de-farmacovigilancia?state=draft
8.2.2 Deberán someterse al CNFV los RPS de los medicamentos o vacunas autorizados en México en las siguientes situaciones:
8.2.2.1 Moléculas nuevas, y
8.2.2.2 A petición de la autoridad sanitaria con base en una preocupación de seguridad o asunto de seguridad.
8.2.4.4 Someter al CNFV, únicamente el RPS durante sus primeros 5 años, posterior al otorgamiento de su registro sanitario, los que corresponden al punto 8.2.2.1. En los períodos estipulados en el punto 8.2.4.
8.2.6.3 Trianuales: Deberán ser elaborados e integrados a sus expedientes y estar a disposición de la autoridad cuando éstos sean requeridos.
8.2.7.3 Los medicamentos huérfanos, únicamente someterán el RPS al CNFV durante los primeros 5 años, posterior al otorgamiento por primera vez en México del oficio de reconocimiento de medicamento huérfano.
8.2.9. De acuerdo al punto 8.2.2.1 para los medicamentos y vacunas que cuenten con registro sanitario y no hayan sido comercializados en el país, en cualquier momento durante los primeros 5 años posteriores al otorgamiento del registro sanitario, deberán enviar al CNFV el formato de no comercialización. Dicho formato se someterá por única ocasión por todo el tiempo que dure la no comercialización.
8.2.10.1 Cuando un medicamento o vacuna no comercializado de acuerdo al punto 8.2.2.1, inicie su comercialización, deberá entregar su RPS cumpliendo con el contenido establecido en el punto 8.2.3 de la presente Norma, en los períodos de información y envío especificados en el punto 8.2.4 de la presente Norma. Para cumplimiento de la periodicidad de sometimiento, se tomará como base la fecha de inicio de comercialización en el país. El RPS podrá acompañarse con el reporte e información de seguridad internacional cuando aplique.
8.3.1 Este punto aplica a todos los estudios clínicos, patrocinados o no, incluyendo a los de bioequivalencia, que cuenten con al menos un sitio o centro de investigación en México.
8.4.1 Elaborar un PMR para medicamentos y vacunas cuando:
8.4.1.1 Se registre una molécula nueva en el país.
8.4.1.2 Se deroga
8.4.1.3 Se deroga
8.4.1.4 Se otorgue oficio de reconocimiento por primera vez en el país como medicamento huérfano.
8.4.1.7 Se deroga.
8.4.2.2 Se deroga.
8.4.2.5 Se deroga.
8.4.3 El PMR deberá elaborarse de acuerdo a lo establecido en la "Guía de Farmacovigilancia para la elaboración de PMR", publicada por el CNFV en http://www.gob.mx/cofepris/documentos/guias-lineamientos-y-requerimientos-de-farmacovigilancia?state=draft, y deberán presentar al menos la siguiente información
8.4.3.1 Se deroga.
8.4.3.1.1 Se deroga.
8.4.3.1.1.1 Se deroga.
8.4.3.1.1.2 Se deroga.
8.4.3.1.1.3 Se deroga.
8.4.3.1.1.4 Se deroga.
8.4.3.1.2.1 Se deroga.
8.4.3.1.2.2 Se deroga.
8.4.3.1.2.3 Se deroga.
8.4.3.1.2.4 Se deroga.
8.4.3.1.2.5 Se deroga.
8.4.3.1.2.6 Se deroga.
8.4.3.1.3.2 Actividades adicionales (Puede incluir estudios de Farmacovigilancia o clínicos).
8.4.3.1.4.2. Actividades adicionales.
8.4.3.2 Se deroga.
8.4.3.2.1 Se deroga.
8.4.3.2.2 Se deroga.
8.4.3.2.3 Se deroga.
8.4.3.2.3.1 Se deroga.
8.4.3.2.3.2 Se deroga.
8.4.3.2.4 Se deroga.
8.4.3.2.4.1 Se deroga.
8.4.3.2.4.2 Se deroga.
8.4.3.3 Se deroga.
8.4.3.3.1 Se deroga.
8.4.3.3.2 Se deroga.
8.4.3.3.3 Se deroga.
8.4.3.3.3.1 Se deroga.
8.4.3.3.3.2 Se deroga.
8.4.3.3.4 Se deroga.
8.4.3.3.4.1 Se deroga.
8.4.3.3.4.2 Se deroga.
8.4.4 Se deroga.
8.4.4.1 Se deroga.
8.4.4.1.1 Se deroga.
8.4.4.2 Se deroga.
8.4.4.2.1 Se deroga.
8.4.4.2.2 Se deroga.
8.4.4.2.3 Se deroga.
8.4.4.2.4 Se deroga.
8.4.4.2.5 Se deroga.
8.4.4.3 Se deroga.
8.4.4.3.1 Se deroga.
8.4.4.3.2 Se deroga.
8.4.4.3.3 Se deroga.
8.4.5.1 ...
Se deroga último párrafo.
8.4.5.2 Se deroga.
8.4.5.3 Se deroga.
8.4.5.4 Se deroga.
8.4.5.5 Se deroga.
8.4.5.6 Se deroga.
8.4.5.7 Se deroga.
8.4.5.8 Se deroga.
8.5.3 La elaboración del Informe de Farmacovigilancia será de conformidad con la "Guía de Farmacovigilancia para la elaboración del Informe de Farmacovigilancia, publicada por el CNFV en http://www.gob.mx/cofepris/documentos/guias-lineamientos-y-requerimientos-de-farmacovigilancia?state=draft
9.3 EMA. Guideline on good pharmacovigilance practices. Module V "Risk Management Systems", 2016.
9.5 EMA. Guideline on good pharmacovigilance practices. Module VII "Periodic Safety Report", 2015.
TRANSITORIOS
PRIMERO.- La presente modificación de la Norma Oficial Mexicana entrará en vigor al día siguiente de su publicación en el Diario Oficial de la Federación.
SEGUNDO.- Los trámites ingresados previamente a la entrada en vigor de la presente modificación se resolverán conforme a las disposiciones aplicables al momento de su presentación.
TERCERO.- Los trámites ingresados con anterioridad a la entrada en vigor de la presente modificación, podrán ser resueltos en sus términos previa solicitud simple al correo electrónico farmacovigilancia@cofepris.gob.mx
Ciudad de México, a 28 de agosto de 2020.- El Comisionado Federal para la Protección contra Riesgos Sanitarios y Presidente del Comité Consultivo Nacional de Normalización de Regulación y Fomento Sanitario, José Alonso Novelo Baeza.- Rúbrica.